手性轮烷作为机械互锁分子家族的重要成员,在不对称催化与智能材料等领域展现出广阔前景。美国西北大学/中国香港大学Stoddart团队,英国曼彻斯特大学Leigh团队、中国华东师大杨海波团队、英国伯明翰大学Goldup团队、德国杜伊斯堡-埃森大学Niemeyer团队、日本京都大学Ogoshi团队等取得了卓越的成果;其中,基于具有动态pR/pS平面手性的柱[5]芳烃这一类大环主体所构建的轮烷体系,因其特殊的平面手性,尤其适于发展手性传感、圆偏振发光等功能材料。通过修饰轴组分可实现对轮烷结构的精准调控与功能化拓展。然而,该类轮烷的合成与纯化主要依赖手性色谱分离,由于其步骤繁琐、成本高昂且难以放大,严重制约了其实际应用与系统开发。
针对这一技术瓶颈,太阳成集团超分子团队强琚莉课题组基于多年来在氨基酸诱导柱芳烃手性领域的研究积累,创新性地提出了一种“轴环诱导”新策略。该策略通过将赖氨酸衍生物作为轮烷轴组件的一部分,有效诱导柱[5]芳烃大环组件的平面手性,通过封端反应将诱导产生的手性构型锁在轮烷结构中,由此获得的[2]轮烷产物为一对非对映异构体,可利用常规硅胶柱色谱实现高效分离,并通过该策略成功构筑具有圆偏振发光的手性轮烷。
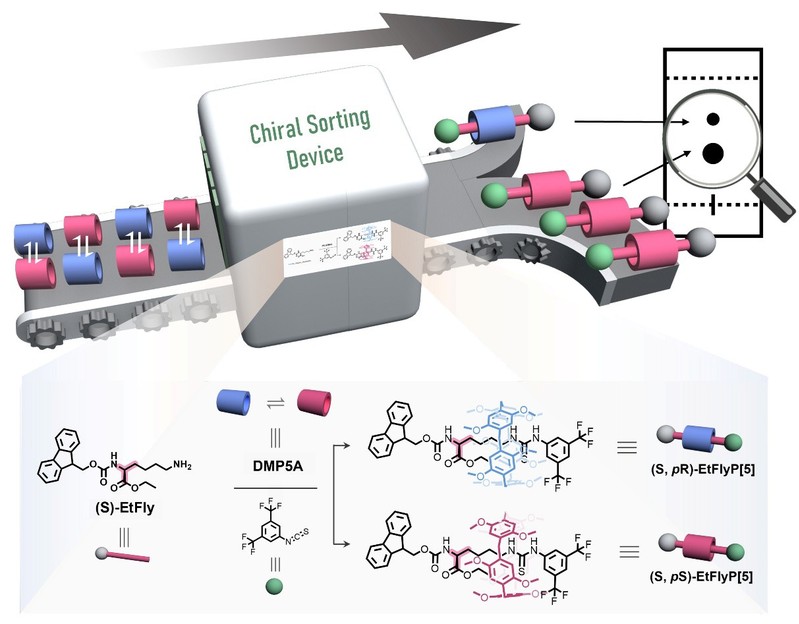
图1. 轴-环诱导策略实现手性[2]轮烷的合成。
首先,研究团队以外消旋赖氨酸衍生物(rac-EtFly)修饰的轴分子与大环分子DMP5A组装,成功构建了轮烷。该轮烷体系同时具备来自赖氨酸的静态点手性和来自柱芳烃大环的动态平面手性,理论上可形成两对对映体。实验结果表明,通过薄层色谱可清晰观察到两个产物点,分别对应两种轮烷异构体rac-EtFlyP[5]-1和rac-EtFlyP[5]-2,且两者可通过常规硅胶柱色谱实现高效分离。高分辨质谱、核磁共振波谱及单晶X射线衍射分析共同证实,rac-EtFlyP[5]-1由(S, pR) 和(R, pS) 构型组成,而rac-EtFlyP[5]-2则由(S, pS) 和(R, pR) 构型组成。¹H NMR中轴质子显著的高场位移表明大环对轴组件产生屏蔽效应,NOESY谱中观察到硫脲质子与DMP5A芳香质子之间的空间邻近信号,证实了轮烷的有效形成与空间关系。单晶结构解析显示,(S, pS)构型中轴呈特征性的L型弯曲(88.5°),使得芴基更靠近大环,并通过更强的氢键和C–H···π作用稳定其结构,从而解释了该构型更高产率的实验现象。
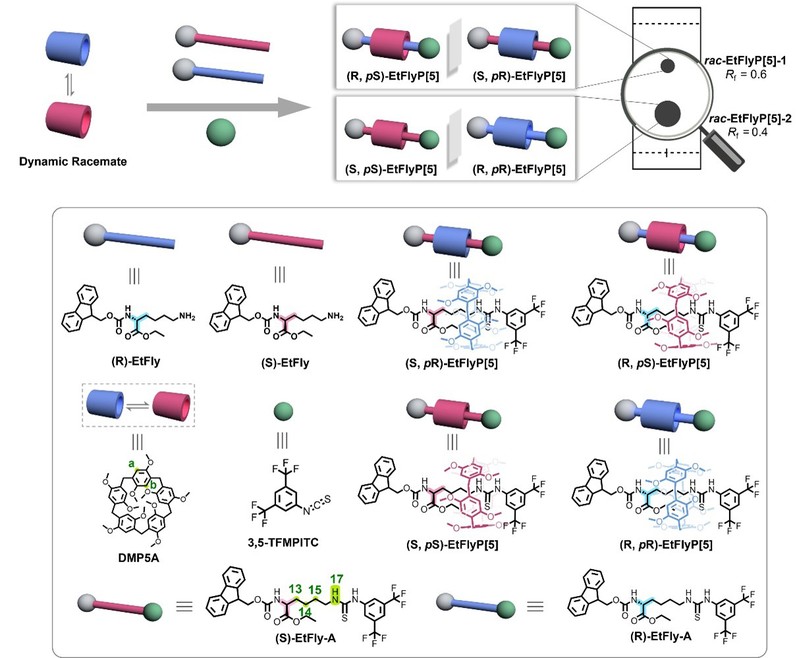
图2. rac-EtFlyP[5]-1和rac-EtFlyP[5]-2的结构示意图。
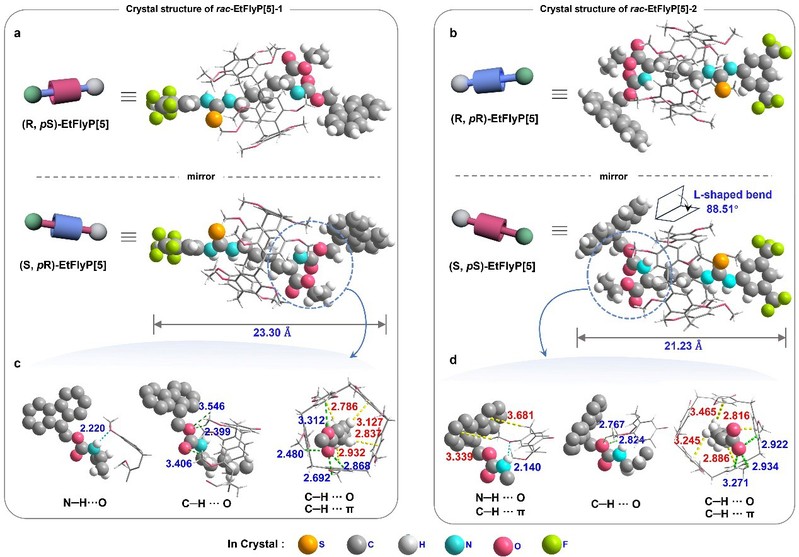
图3. rac-EtFlyP[5]-1和rac-EtFlyP[5]-2的晶体结构图。
研究人员进一步以手性纯(S)-EtFly和(R)-EtFly为轴合成了手性轮烷,非对映异构体比例约为1:3,显示出明显的立体选择性。圆二色光谱表明,(S, pS)-EtFly与(R, pS)-EtFly 在250 nm和302 nm处表现出负Cotton效应,而(S, pR)-EtFly与(R, pR)-EtFly则显示正Cotton效应。该结果表明,赖氨酸修饰轴兼具手性诱导源与轮烷结构骨架的双重角色。
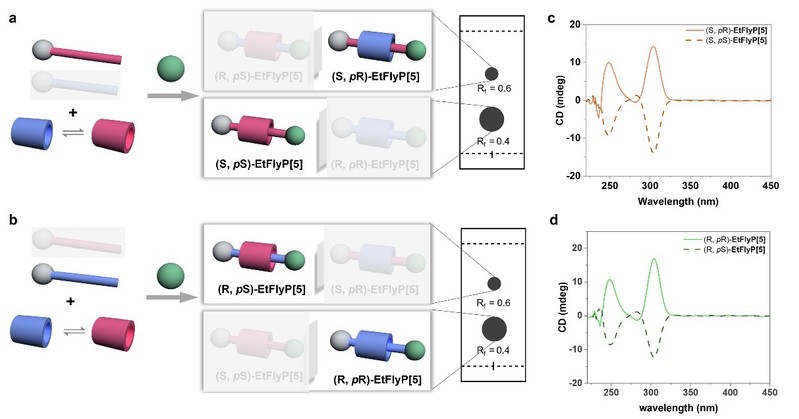
图4. 手性[2]轮烷合成过程示意图。
为验证该策略的普适性,研究团队还尝试了其他烷基链取代的轴单元(如MeFly和nPrFly),结果表明S构型轴与pS大环结合能形成更稳定的轮烷结构,理论计算显示其能量比非优势立体结构低3.56–5.12 kcal/mol。此外,该策略还被成功拓展至功能型轮烷的构建。通过引入芘发光团,团队合成了具有圆偏振发光(CPL)特性的手性轮烷,在470 nm处表现出明显的CPL信号,实现了从分子手性到圆偏振发光功能的有效传递。这一轴-环诱导策略不仅为基于DMP5A的手性轮烷提供了产物无需手性拆分的合成方法,也为合成从轮烷到索烃乃至更复杂的拓扑结构的手性机械互锁分子与手性材料提供了创新思路。
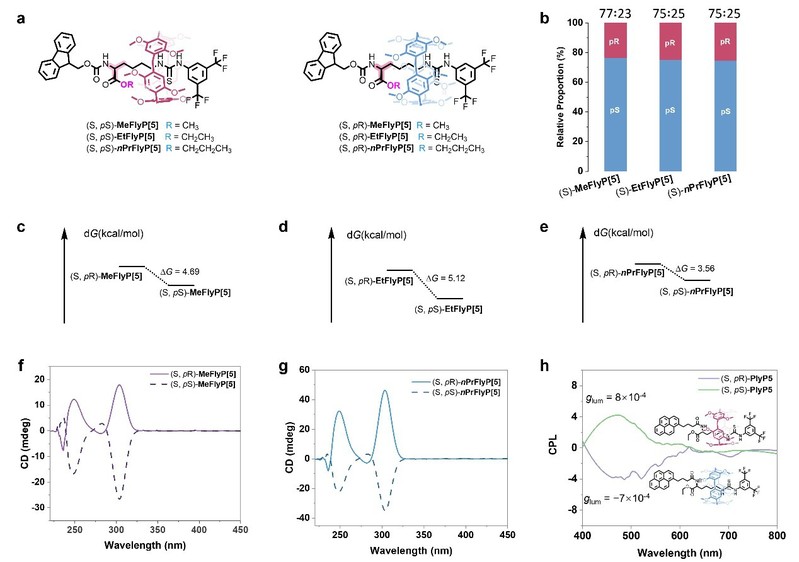
图5. 轴组分对手性轮烷合成立体选择性的调控。
相关成果以“An Axle-Cycle Induction Strategy for the Synthesis of Chiral [2]Rotaxanes”为题发表于J. Am. Chem. Soc.(DOI: 10.1021/jacs.5c10122)。太阳集团tcy87222021级博士生王冉冉为该文章第一作者,太阳成集团强琚莉副教授、杭州师范大学倪志刚副教授为共同通讯作者。倪志刚副教授为公司2019届博士毕业生(导师为黎书华教授)。王乐勇教授在文章的书写和修改方面提出了宝贵意见。特别感谢太阳集团tcy8722梁勇教授、历史公司王晓琪副教授以及地球科学与工程公司陆现彩教授的宝贵建议与支持。博士生石聪浩、解旺、徐光宙、周炀、班世蓉共同参与了这一研究工作。本工作得到国家自然科学基金、江苏省自然科学基金等经费支持。
